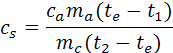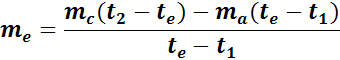LABORATORIO
MISURE
Con i rispettivi cursori scegliere:
-
Il materiale e la massa del campione di metallo che poniamo nel beaker. (Il campione deve essere ricoperto da una sufficiente quantità d'acqua.)
-
La quantità d'acqua posta nel calorimetro e la sua temperatura iniziale.
-
Cliccare su "reset" per inizializzare la simulazione.
-
Spostare il cursore "Fornello" su "acceso"
-
Aspettare che l'acqua bolla
-
Spostare il campione dal beaker nel calorimetro (poi si può spegnere il fornello)
-
L'acqua del calorimetro comincia a scaldarsi fino a raggiungere una temperatura di equilibrio te
Per comodità riportiamo in ordine le grandezze misurate:
ma=.............. (massa dell'acqua versata nel calorimetro)
mc = ............. (massa del campione)
me= 30 g (equivalente in acqua del nostro calorimetro)
t1= .............. (temperatura iniziale dell'acqua contenuta nel calorimetro)
t2=............... (temperatura del campione prima dell'immersione nel calorimetro = temperatura dell'acqua
nel beaker. Leggere la temperatura nel momento in cui si sposta il campione dal beaker al calorimetro)
te = .............. (temperatura finale di equilibrio tra acqua e campione immerso nel calorimetro)
Se abbiamo avuto cura di chiudere bene il coperchio del calorimetro possiamo affermare che tutto il calore perso dal campione metallico è stato assorbito dall'acqua nel calorimetro, quindi usando la relazione fondamentale della termologia Q = c m ∆t possiamo ricare la formula per calcolare il calore specifico del metallo (vedi teoria):
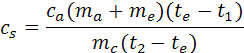
dove ca è il calore specifico dell'acqua che in queste misure si può porre uguale a 1cal/(g°C)
Si riporta un esempio
Misura del calore specifico del ferro
ma = 100g
mc = 100g
t1 = 8°C
t2 = 100°C
Sul termometro del calorimetro leggiamo la temperatura d'equilibrio: te = 15°C
Applicando la formula si ottiene: cs del ferro =0.107 cal/(g°C)
Calore specifico di alcuni metalli
| Sostanza | cal/(g × °C) | J/(kg × °C) |
| Alluminio | 0.21 | 896 |
| Argento | 0.057 | 239 |
| Rame | 0.092 | 385 |
| Zinco | 0.096 | 389 |
| Piombo | 0.031 | 129 |
| Ferro | 0.108 | 450 |
| Stagno | 0.057 | 239 |
| Bronzo | 0.091 | 380 |
| Invar (lega di acciaio al 36% di Ni) | 0.11 | 460 |
| Ottone | 0.091 | 380 |
| Oro | 0.031 | 129 |
TEORIA
MISURA DEL CALORE SPECIFICO DEI METALLI
Il calore specifico di un corpo è una costante che dipende solo dalla sostanza di cui è costituito il corpo. Quantitativamente esso è espresso dalla formula:
Il calore specifico è il rapporto tra la quantità di calore scambiata da un corpo conseguentemente ad una variazione di temperatura ∆t e il prodotto della massa per la variazione della temperatura.
Il calorimetro delle mescolanze è lo strumento usato per determinare
i calori specifici delle sostanze. Si tratta di un
thermos con le pareti rivestire da un materiale isolante in modo da
rendere minima la dispersione di calore verso l'esterno. Il coperchio ermetico è dotato
di due fori che consentono l’introduzione di un termometro e di un
agitatore per uniformare la temperatura del liquido contenuto
all’interno.
Nel calorimetro sia contenuta una massa d’acqua ma ad una temperatura
t1.
Se mettiamo nel calorimetro un oggetto di metallo di massa
mc ad una temperatura
t2>
t1
, dopo un certo tempo, viene raggiunta la temperatura di
equilibrio
te.
La quantità di calore ceduta dall’oggetto di metallo
mc
è:
dove cs è il calore specifico del metallo. In assenza di dispersioni Q2 dovrebbe essere uguale alla quantità di calore Q1 assorbita dalla massa di acqua ma avente calore specifico ca:
pertanto il calore specifico del metallo è determinabile dalla
relazione: